« lun. 17 mars - dim. 23 mars | Page d'accueil
| lun. 31 mars - dim. 06 avril »
24/03/2008
L’étude ADVANCE.
Cette note est pour moi à la fois une grande première et une grande joie.
Pour la première fois dans la courte histoire de « Grange Blanche », j’ai laissé le clavier à un invité pour la note qui va suivre.
C’est aussi une grande joie car cet invité est le Dr Jean-Paul Joseph, un cardiologue brillant, gentil, affable et dont la curiosité est insatiable.
Jean-Paul est un peu mon mentor, celui qui m’a fait voir qu’il fallait aller au-delà de la simple lecture des résumés des études pour pouvoir vraiment se faire une opinion sur l’intérêt de telle ou telle molécule, telle ou telle stratégie de prise en charge des patients.
Il m’a montré que l’on pouvait assez facilement « rendre » positive une étude, avec des artifices de méthodologie et de statistiques, et qu’il fallait donc entraîner son esprit critique afin de tirer les bonnes conclusions qui nous permettront de soigner correctement nos patients.
On ne peut (malheureusement) plus simplement se contenter de vérifier qu’une étude est « randomisée, contrôlée, en double aveugle, multicentrique » ou qu’elle est publiée dans une grande revue pour lui faire confiance aveuglément.
Ne parlons même pas des recommandations des « leaders d’opinion » et des présentations des visiteurs médicaux qui sont parfois les mêmes.
Nous sommes des médecins, non des statisticiens ni des méthodologiques, et « creuser » une étude demande des compétences et du temps que la plupart d’entre nous n’avons pas.
Toutefois, ce n’est pas une raison pour ne pas être curieux, ne pas vouloir « s’éveiller » et ne pas vouloir savoir ce qui se passe à l’envers du décor.
Jean-Paul a rédigé une superbe analyse de l’étude ADVANCE, et il a bien voulu me la laisser publier dans ce blog. J’ai par ailleurs rajouté quelques remarques personnelles en caractères italiques.
Détendez vous, concentrez vous et ouvrez vos chakras, et laissez-vous guider par Jean-Paul dans les méandres de l’étude ADVANCE…
(la seconde partie de cette note, qui est de mon cru, et donc bien moins sérieuse est ici).
*/*/*/*/*/*/*/*/*/*
Conclusion des auteurs :
L’administration systématique d’une association fixe de Perindopril et d’Indapamide à une large population de patients diabétiques diminue les risques de mortalité et de complications macrovasculaires ou microvasculaires majeures, quels que soit le niveau initial de pression artérielle ou les multiples traitements associés actuellement prescrits à titre préventif chez les diabétiques. Si on appliquait les bénéfices observés dans l’étude Advance ne serait-ce qu’à la moitié de la population mondiale des diabétiques, plus d’un million de DC pourraient être évités en 5 ans. Pour toutes ces raisons, on peut désormais envisager ce TRT de façon systématique chez les diabétiques de type 2
L’étude Advance est intéressante, mais la conclusion des auteurs est fausse
1) méthodologie
Advance est une étude en plan factoriel conçue d’une part pour évaluer les effets sur les évènements vasculaires d’une stratégie associant de manière fixe un IEC le Perindopril et un diurétique l’Indapamide chez des diabétiques de type 2 indépendamment de leur pression artérielle (c’est l’objet de la publication du 2/9/2007 dans le Lancet) et d’autre part pour évaluer si un contrôle strict glycémique à base de Glicazide 30 mg avec pour objectif une HbA1c < 6,5% permet de diminuer les évènements vasculaires.
Advance est une étude contrôlée, randomisée, en double aveugle contre placebo, effectuée par 215 centres dans 20 pays en Asie, Australie, et Amérique du Nord.
Critères d’inclusion :
- diabète de type 2 diagnostiqué à l’âge de 30 ans ou plus.
- âge de 55 ans ou plus.
- et l’un au moins des critères suivants : ATCD majeur de pathologies cardiovasculaires (AVC, IDM, hospit pour AIT, hospitalisation pour angor instable, revascularisation coronaire, revascularisation periphérique ou amputation secondaire à une atteinte vasculaire).
- ou au moins l’un des facteurs de risque suivants : ATCD majeur d’évènement microvasculaire (protéinurie, rétinopathie diabétique proliférative, traitement par photocoagulation rétinienne, œdème maculaire, ou cécité monoculaire du fait du diabète), tabagisme actif, cholestérol total > 6 mmol/l (2,34 g/l), HDL-cholestérol < 1mmol/l (0,40g/l), microalbuminurie, ancienneté du diabète > 10 ans, âge > 65 ans.
L’étude ne comportait aucun critère d’inclusion sur la pression artérielle.
Les patients éligibles ont été soumis à une phase de « run-in » de 6 semaines pendant laquelle ils ont reçu un comprimé de l’association fixe perindopril 2mg et Indapamide 0,625mg.
Les autres traitements ont été maintenus, mais les patients recevant un IEC autre que le perindopril devaient le remplacer en ouvert par le perindopril à 2 ou 4mg.
Les patients ayant bien toléré et adhéré au traitement pendant le run-in ont été randomisés en double aveugle pour recevoir soit une association fixe de perindopril 2mg et d’indapamide 0,625mg soit un placebo. Au bout de 3 mois, les doses de traitement étaient doublées.
L’utilisation de diurétiques thiazidiques était interdite et le perindopril en ouvert était le seul IEC autorisé à la dose maxi de 4 mg.
Deux critères principaux étaient initialement prévus :
- évènements macrovasculaires majeurs : décès d’origine CV, IDM non fatals, ou AVC non fatals
et
- évènements microvasculaires majeurs : survenue ou aggravation d’une néphropathie (apparition d’une protéinurie, doublement de la créatininémie avec une valeur d’au moins 200 micmol/l, nécessité d’une dialyse ou décès dû à une néphropathie) ou d’une rétinopathie (apparition d’une rétinopathie proliférative, d’un œdème maculaire ou d’une cécité due au diabète, ou traitement par photocoagulation rétinienne)
en utilisant un test bilatéral à 5%.
Analyse prévue en intention de traiter.
En novembre 2005, les analyses des critères principaux ont été élargies pour inclure l’analyse des évènements macrovasculaires et microvasculaires majeurs aussi bien conjointement que séparément.

Ce point particulier des critères principaux est fondamental. Le texte de l'article du Lancet est le suivant:

En 2001, la structure de l'étude a été publiée dans Diabetologia:

Je ne sais pas pour vous, mais je touve le texte du Lancet bien moins explicite. C'est peut-être mon anglais défaillant, mais j'ai dû lire plusieurs fois l'article du Lancet pour comprendre qu'il y avait initialement deux critères principaux, composés chacun de critères composites. Pourquoi donc ne pas avoir repris la formulation limpide de l'article de Diabetologia ??
Soyons bien clairs, au beau milieu de l'étude,"Half-way through...", un troisième objectif primaire agglomérant les deux premiers, et donc englobant bien plus d'évènements cliniques disparates a été ajouté (l'infarctus du myocarde côtoie la photocoagulation rétinienne). L'inclusion du dernier patient date du 24 janvier 2003 (cf l'article de "Drugs" mis en référence), et la modification du protocole a eu lieu donc largement après, le 30 novembre 2005.
In fine, on le verra plus tard, seul cet objectif primaire rajouté bien tardivement sera positif, et rendra donc ADVANCE "positive", du moins en apparence...
Par ailleurs, le traitement et le suivi du bras tension artérielle a été prolongé d’un an.
Critères secondaires :
- décès toutes causes,
- décès cardiovasculaires,
- évènements coronaires majeurs (décès coronaires dont les morts subites et IDM non fatals), tous les évènements coronaires (évènements coronaires majeurs, IDM silencieux, revascularisation coronaire, ou hospitalisation pour angor instable),
- évènements vasculaires cérébraux majeurs (décès par AVC ou AVC non fatals),
- tous les évènements vasculaires cérébraux (évènements vasculaires cérébraux majeurs, AIT, ou hémorragie sous-arachnoidienne)
Estimation des effets du traitement à partir du modèle des risques proportionnels de Cox non ajustés
2) Financement.
SERVIER et le NHMRCA (National Health and Medical Research Council of Australia)
3) Résultats avancés par les auteurs.
12877 patients éligibles et 1737 (13,5%) sortis de l’étude pendant la phase de run-in, donc 11140 randomisés.
Caractéristiques de base des patients bien équilibrées entre les 2 groupes avec notamment 32% de patients avec des ATCD d’évènements macrovasculaires majeurs (12% d’IDM).
La pression artérielle moyenne des patients inclus était de 145/81 mmhg (41% avaient une PAS < 140 et une PAD < 90) et a été dans le bras traitement actif en fin d’étude plus basse en moyenne de 5,6 mmhg pour la PAS et de 2,2 mmhg pour la PAD pour atteindre en moyenne 135/75.
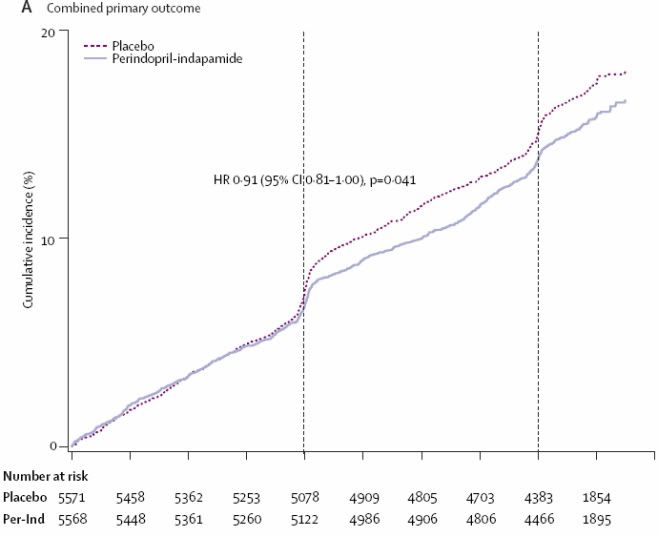
1799 patients ont eu un évènement macrovasculaire majeur ou microvasculaire majeur pendant le suivi : 861 (15,5%) dans le groupe traitement actif et 938 (16,8%) dans le groupe placebo, soit une baisse de 9% du RR (IC 95% du RR 0,83 à 1) p = 0,041.
Les effets du TRT actif sur les évènements macrovasculaires majeurs ( baisse du RR de 8%) et microvasculaires majeurs (baisse du RR de 8%) étaient similaires mais non significatifs lorsque analysés séparément.
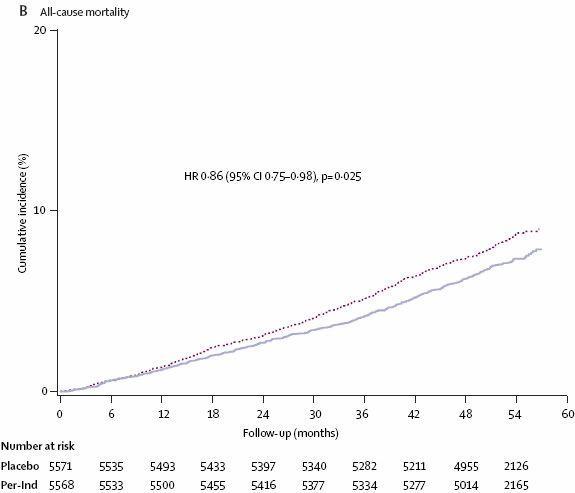
Pendant l’étude, 879 patients sont décédés : 408 (7,3%) dans le groupe TRT actif et 471 (8,5%) dans le groupe placebo c’est à dire baisse du RR de 14% (IC 95% 0,75 à 0,98). Donc, sur 5 ans, il est estimé qu’un DC a été évité pour 79 patients ayant reçu le TRT actif (IC 95% 43 à 483).
En outre dans le groupe TRT actif, moins de décès CV, moins d’évènements coronaires totaux, pas de différence pour l’ensemble des évènement vasculaires cérébraux, moins d’évènements rénaux totaux, moins d’apparition ou d’aggravation d’une néphropathie (c’est faux), moins d’apparition d’une microalbuminurie, pas de différence pour l’apparition ou l’aggravation d’une rétinopathie.
Les effets du TRT sur le critère combiné associant évènements macro et micro étaient comparables dans les différents sous groupes et pas d’interaction entre l’effet du TRT et le niveau de pression artérielle initiale.
4) Discussion selon les auteurs
Baisse de 16,8 à 15,5 % du risque d’évènements macrovasculaires ou microvasculaires majeurs, ce qui suggère que un évènement est évité pour 66 patients traités sur 5 ans.
Un DC évité sur 5 ans pour 79 patients traités.
Aucun ajustement statistique multiple n’a été effectué malgré l’ajout d’un critère principal aux 2 initialement prévus = « car les résultats concernant les critères principaux sont cohérents ».
Pas d’action sur les évènements vasculaires cérébraux sans doute due au hasard.
Stratégie par association fixe bien tolérée : observance à 4,3 ans de 73% sous TRT actif et 72% sous Placebo.
En résumé :
- l’administration systématique d’une association fixe de Perindopril et d’Indapamide à une large population de patients diabétiques diminue les risques de mortalité et de complications macrovasculaires ou microvasculaires majeures, quels que soit le niveau initial de pression artérielle ou les multiples traitements associés actuellement prescrits à titre préventif chez les diabétiques.
- Si on appliquait les bénéfices observés dans l’étude Advance ne serait-ce qu’à la moitié de la population mondiale des diabétiques, plus d’un million de décès pourraient être évités en 5 ans.
Pour toutes ces raisons, on peut désormais envisager ce TRT de façon systématique chez les diabétiques de type 2
5) Analyse de la publication
L’étude Advance est intéressante, mais la conclusion des auteurs est fausse
a) la mortalité totale est citée en 1er dans la conclusion alors qu’il s’agit d’un critère secondaire.
b) Phase de run-in : la randomisation ne s’applique pas à nos patients car ils ne l’ont pas subie et les effets secondaire peuvent faire perdre le bénéfice éventuel observés chez les patients randomisés = pénalise le groupe contrôle (comme dans Progress, Europa, TNT, HPS etc.).
c) l’interdiction d’utiliser 1 thiazidique pénalise le groupe contrôle, car on sait que les diurétiques diminuent le risque CV chez le diabétique (méta-analyse INDANA)
(15% lors de la visite d’inclusion).
d) 43% des patients étaient sous IEC lors de la visite d’enregistrement et l’ont interrompu pour entrer dans l’étude c’est à dire que le groupe traitement actif a eu dès le début un IEC (4 à 8 mg de perindopril) de manière systématique et le groupe contrôle une fois sur 2 (55%) seulement en fin de suivi (on ne sait pas quand il a été introduit), alors qu’on connaît le bénéfice des IEC chez les diabétiques = microhope pour le risque CV, Benedict pour la protection rénale..). Le groupe contrôle a donc été pénalisé.
On pourrait objecter à l’inverse que le groupe contrôle a bénéficié en partie des bénéfices d’un IEC et que l’effet dans le groupe traitement actif était plus difficile à mettre en évidence ; certes, mais c’est la règle dans un essai pragmatique.
Pour valider le recours systématique à l’association perindopril indapamide, il aurait fallu comparer 2 stratégies : l’une habituelle ou on poursuit le traitement en cours dont l’IEC mais aussi le thiazidique (et ou on peut introduire si besoin un IEC et un thiazide s’ils n’y sont pas) et l’autre ou on introduit le Périndopril et l’indapamide chez ceux qui n’ont pas d’IEC ni thiazide (et ou on remplace chez ceux qui l’ont IEC et thiazide par Périndopril et indapamide). Cette étude bien sur aurait été négative, sauf à inclure plusieurs centaines de milliers de patients et elle n’aurait pu être réalisée en double aveugle (risque d’avoir double dose d’IEC et thiazide) donc, il ne fallait pas faire advance…
Cette question, ainsi que la question éthique posée par la posologie non optimale des IEC et des diurétiques chez des patients diabétiques dans le groupe placebo ont été soulevés dans trois « lettres aux éditeurs » publiés dans le Lancet :
- Procopiou M. The ADVANCE trial. Lancet. 2008 Jan 5;371(9606):25; author reply 26.
- Dunstan E. The ADVANCE trial. Lancet. 2008 Jan 5;371(9606):25-6; author reply 26.
- Fuchs FD. The ADVANCE trial. Lancet. 2008 Jan 5;371(9606):25; author reply 26.
La réponse des auteurs de ADVANCE :
- Anushka Patel, Stephen MacMahon, Bruce Neal, Laurent Billot, John Chalmers, on behalf of the ADVANCE Collaborative Group. The ADVANCE trial. Lancet. 2008 Jan 5;371(9606):26
e) On ne connaît pas le nombre de coronariens lors de l’inclusion, mais on sait tout de même que 32% avaient un ATCD vasculaire majeurs et surtout 12 % un IDM, hors les patients du groupe TRT actif à qui on a ajouté du perindopril (près de la moitié) ont eu 8mg, contre 4 seulement dans le groupe contrôle et la dose efficace dans Europa est de 8mg. Même commentaire que précédemment.
f) l’intervalle de confiance du risque relatif pour le critère principal mis en avant par les auteurs est de 0,83 à 1, donc le bénéfice est peut être quasiment nul et concernant un critère combiné très large (macro + micro et incluant pour micro des critères intermédiaires…)
g) et surtout le résultat est un échec concernant chacun des 2 critères principaux fixés au départ, ce qui est le résultat réel de l’étude et qui aurait du être annoncé en premier par les investigateurs de l’étude.
De plus le troisième critère principal qui est donc mis en avant par les auteurs aurait également selon toute évidence (vu que l’intervalle de confiance comprend la valeur 1) été également un échec s’il y avait eu ajustement pour comparaisons multiples, ce qui est un minimum lorsque on ajoute un critère principal lorsque l’étude est presque terminée et qu’on conclut sur ce seul critère alors que les 2 autres critères principaux sont des « échecs ».
g) les effets secondaires ne sont pas mentionnés. On parle de 78 effets secondaires graves liés au traitement dont 5 angioedèmes (restent 73…).
h) on souligne que traiter 79 patients pendant 5 ans « sauve » une vie alors que :
- tout individu est mortel : on ne sauve pas, mais on reporte simplement au delà de 5 ans le décès.
- il n’y a pas un individu qui est « sauvé » par le TRT alors qu’il serait mort sans, chaque individu a une baisse de probabilité de mourir.
- la baisse relative des décès est de 14% mais l’intervalle de confiance du risque relatif est de 0,75 à 0,98 = baisse de peut-être seulement 2%.
- et surtout il s’agit d’un critère secondaire (par ex Elite 2 n’a jamais confirmé Elite 1 en ce qui concerne la baisse de mortalité totale observée chez les patients traités par Losartan dans Elite 1 pour tester la tolérance rénale chez les sujets âgés insuffisants cardiaques)
i) on met en évidence ce qui « gagne » = un critère primaire non prévu par le design = évènements macro et micro vasculaires majeurs combinés, les décès totaux, les décès cardiovasculaires, les évènements coronaires totaux, les évènements rénaux totaux (ces derniers n’étant pas un critère prévu), la micro albuminurie, mais pas ce qui « perd » = chacun des 2 critères principaux initiaux de l’étude, les évènements coronaires majeurs, les AVC, les néphropathies, les rétinopathies (tous deux étant les éléments du critère primaire micro vasculaires)
j) la méta-analyse des BPLTC publiée en 2003 montrait que la baisse de la pression artérielle est bénéfique quelle soit les molécules utilisées parmi les 5 grandes classes Beta-bloquants, diurétiques, IEC, ARA2, et inhibiteurs calciques avec un petit plus pour les IEC chez les diabétiques en terme de traitement et de prévention de la néphropathie diabétique.
k) on savait déjà que la baisse de pression artérielle est bénéfique chez le diabétique, même lorsque la pression artérielle n’est pas très élevée (dans microhope, la pression artérielle initiale est en moyenne de 142/80) et qu’un objectif au dessous de 140/80 est recommandé (dans UKPDS 38, le bénéfice est plus grand lorsqu’on atteint 144/82 plutôt que 154/87). Les dernières recommandations de l’HAS 2005 indiquent même un objectif < 130/80 (sans grand niveau de preuve : Steno 2 compare bien 2 stratégies, plus ou moins intensives, mais il s’agit de diabétiques avec micro albuminurie et l’essai surtout n’a inclus que 160 patients)
En conclusion L’étude Advance est intéressante, mais la conclusion des auteurs est fausse
- Intéressante, car on a un argument supplémentaire pour fixer un objectif < 140/80 (voir < 130/80 comme le recommande l’HAS, mais il faudrait une étude correcte comparant différents objectifs). On a aussi un argument supplémentaire pour associer IEC et thiazides chez le diabétique, (avec la réserve que le run-in et la non mention des effets secondaires ne permettent pas d’apprécier correctement la balance bénéfices risques)
- La conclusion des auteurs est fausse pour toutes les raisons évoquées ci-dessus (notamment l’échec sur les deux critères prévus initialement dans le protocole), c'est-à-dire qu’ il n’y a pas lieu de recommander de manière systématique l’association fixe perindopril indapamide chez les diabétiques de type 2
DR Jean-Paul JOSEPH
Cardiologue
Diplôme d’université d’interprétation des essais thérapeutiques 2005 (université de Lyon)
Diplôme de statistique appliquée à la médecine (SESAM) 2005 (université Paris et Aix-Marseille) options
-méthodologie statistique
-pratique des essais cliniques
08/12/2007
°0°0°0°0°0°0°0°0°0°0°0°
ADVANCE Collaborative Group. Effects of a fixed combination of perindopril and indapamide on macrovascular and microvascular outcomes in patients with type 2 diabetes mellitus (the ADVANCE trial): a randomised controlled trial. Lancet. 2007 Sep 8;370(9590):829-40.
ADVANCE management committee. Study rationale and design of ADVANCE: action in diabetes and vascular disease--preterax and diamicron MR controlled evaluation. Diabetologia. 2001 Sep;44(9):1118-20.
Chalmers J. ADVANCE study: objectives, design and current status. Drugs. 2003;63 Spec No 1:39-44. French.
09:42 Publié dans Prescrire en conscience | Lien permanent | Commentaires (3)




