09/05/2007
Le scandale de l’EPO.
Pour une fois, pas une histoire de cyclistes, mais de médecins.
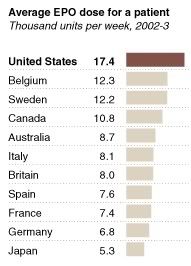
Le New-York Times a révélé que la prescription colossale d’EPO aux Etats-Unis (presque 2.35 fois plus que chez nous) était en partie « dopée » par les rabais concédés par les laboratoires pharmaceutiques aux médecins prescripteurs.
Le système est assez simple : le labo vend au médecin de l’EPO avec un gros rabais, et ce dernier le facture à son patient au prix du marché.
Les sommes sont assez colossales : un groupe de 6 cancérologues a ainsi empoché 2.7 millions de dollars l’an dernier en ayant vendu pour 9 millions de dollars d’EPO.
Comme l’explique très bien l’article, le flou qui entoure le taux idéal d’hémoglobine à atteindre chez un patient dialysé ou cancéreux ainsi que la lutte féroce entre deux laboratoires concurrents sont responsables d’un tel emballement.
Par ailleurs, la FDA a récemment soulevé de nouveau les dangers de prescrire de l’EPO de manière abusive.
Ces dangers avaient déjà été évoqués dans une étude assez ancienne, datant du début des années 90, mais curieusement, personne ne s’en était vraiment inquiété.
"J'ai prescrit de l'EPO à l'insu de mon plein gré" aurait déclaré un oncologue californien.
20:00 Publié dans Prescrire en conscience | Lien permanent | Commentaires (6)
02/05/2007
Déculottées.
Le dernier numéro de Prescrire (mai 2007) en est riche.
La première, celle d’un laboratoire qui a pris ses rêves pour des réalités sur les performances de sa dernière trouvaille.
Pour le plaisir, je vous ai reproduit l’intégralité du texte publié au JO interdisant un visuel promotionnel.
Comme quoi, il faut toujours se méfier de ce que l’on vous montre entre deux consultations, on y trouve parfois des « coquilles ».
Probablement l'oeuvre d'un traducteur facécieux.
« JO n° 56 du 7 mars 2007
Journal Officiel
Lois et décrets
Décrets, arrêtés, circulaires
Textes généraux
Ministère de la santé et des solidarités
Décision du 22 janvier 2007 interdisant des publicités pour des médicaments mentionnées à l'article L. 5122-1, premier alinéa, du code de la santé publique, destinées aux personnes appelées à prescrire ou à délivrer ces médicaments ou à les utiliser dans l'exercice de leur art
NOR : SANM0720352S
Par décision du directeur général de l'Agence française de sécurité sanitaire des produits de santé en date du 22 janvier 2007 :
Considérant qu'il ressort notamment des dispositions de l'article L. 5122-2 du code de la santé publique, que la publicité doit présenter le médicament de façon objective ;
Considérant que le laboratoire Servier, 22, rue Garnier, 92200 Neuilly-sur-Seine, a diffusé une publicité relative à la spécialité Procoralan - poster ;
Considérant qu'en deuxième page du document, l'allégation « efficacité anti-ischémique et antiangoreuse démontrée contre aténolol » est illustrée par la présentation graphique des résultats de l'étude Initiative de Tardif JC et al. sur la durée totale de l'exercice en fin de dose, le délai d'apparition du sous-décalage de 1 mm du segment ST en fin de dose et l'évolution de la fréquence cardiaque en fin de dose. Cette allégation n'est pas fondée dans la mesure où l'étude précitée démontre la non-infériorité des deux traitements. En conséquence, l'utilisation de cette allégation n'est pas pertinente ;
Considérant en outre que lors de la présentation des résultats de l'étude précitée, le document met en exergue pour la tolérance « les effets secondaires les plus fréquents dans le groupe Procoralan ont été des effets visuels transitoires, à type de phosphènes (moins de 1 % de sortie d'essai), pas de phénomène de rebond à l'arrêt brutal de Procoralan ». Cette présentation n'est pas objective dans la mesure où :
- aucun résultat relatif à la tolérance de l'aténolol n'est présenté ;
- les conclusions en terme de tolérance, telles que précisées dans l'EPAR de Procoralan, notamment sur la base de cette étude, précisent que l'incidence globale des effets indésirables était supérieure avec Procoralan par rapport à l'aténolol, notamment due à des taux plus élevés de troubles visuels et de désordres cardiaques ;
- elle tend à minimiser les troubles visuels tels que validés par l'autorisation de mise sur le marché de Procoralan, qui présente comme très fréquents (> 1/10) les troubles visuels de type phosphènes, et tels que validés par l'EPAR, qui précise 14,5 % pour ces mêmes troubles ;
Considérant qu'ainsi ce document est contraire aux dispositions de l'article L. 5122-2 susmentionnées du code de la santé publique,
les publicités, sous quelque forme que ce soit, pour la spécialité pharmaceutique Procoralan, reprenant les allégations mentionnées ci-dessus sont interdites. »
Deuxième déculottée, bien plus sympathique, celle-là.
Savez vous quel est le délai médian d’éjaculation après pénétration vaginale ?
D’après une étude effectuée sur 491 couples dans 5 pays, il est de 5.4 minutes (55 secondes-44.1 minutes).
Plus les hommes prennent de l’âge, plus ce délai diminue (6.5 minutes entre 18 et 30 ans, 4.3 minutes chez les 51 ans et plus).
Chez 50% des hommes, ce délai est inférieur à 6 minutes.
Très bien cette étude, je l’ai affichée dans la chambre à coucher.
13:10 Publié dans Prescrire en conscience | Lien permanent | Commentaires (3)
01/05/2007
Les critères composites.
Je suis tombé ce matin sur un article du BMJ traitant des critères composites.
Qu’est ce que c’est, un critère composite ?
Dans une étude clinique comparative, on doit choisir au préalable un critère principal pertinent et éventuellement des critères secondaires.
Ce critère principal, nécessairement unique peut être composé de plusieurs points de comparaison.
Prenons un exemple.
Le « Collaborative Study Group » a publié dans le NEJM en 2001 une étude comparant l’effet rénoprotecteur de l’Irbésartan, de l’amlodipine et d’un placebo chez les diabétiques de type 2 (N Engl J Med 2001;345:851-60).
Cette étude incluait 1715 patients pour une durée de suivi de 2,6 ans.
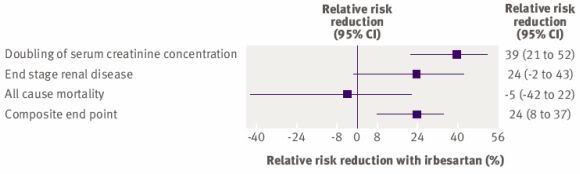
Le critère d’étude principal était composé des trois évènements suivants :
Doublement de la créatininémie
Développement d’une insuffisance rénale terminale (c'est-à-dire créatinine > 6.0 mg/dl, nécessité d’une dialyse permanente ou transplantation rénale)
Décès, toutes causes confondues
Dans le groupe Irbésartan, on observait une diminution de la survenue de ce critère principal composite de 20% par rapport au placebo (p=0.02) et 23% par rapport à l’amlodipine (p=0.006). Et cela, indépendamment des chiffres tensionnels.
Autrement dit, 20 et 23% de moins de doublement de la créatinine, d’insuffisance rénale terminale et de décès.
Magnifique résultat qui a contribué au succès de la prescription des « sartans » chez les diabétiques de type 2.
Quel est l’intérêt d’étudier un critère composite ?
Primo, il permet d’étudier plusieurs facettes d’un état pathologique, qui est nécessairement complexe. Un seul critère, même pertinent ne peut qu’éclairer qu’une de ces facettes. Le critère composite cité en exemple va s’intéresser à la dégradation de la fonction rénale, à la nécessité de dialyser et à la mortalité. On balaye ainsi l’ensemble du spectre de la maladie rénale chez le diabétique.
Secundo, et c’est bien pratique, ce moyen va permettre de multiplier le nombre d’évènements au cours de l’étude, d’optimiser sa puissance statistique, de diminuer le nombre nécessaire de patients, donc, in fine de considérablement diminuer les coûts de cette étude.
Les auteurs du BMJ ont analysés 114 études randomisées dont le critère principal était un critère combiné.
Les revues ou ont été publiées ces papiers sont toutes prestigieuses : Lancet, Annals of Internal Medicine, Circulation, European Heart Journal, JAMA, et New England Journal of Medicine.
Et bien, ils ont eu quelques surprises.
Primo, seuls 68% des articles donnent des données complètes sur le critère principal composite étudié.
Secundo, dans 54% des cas, les évènements étudiés étaient très ou moyennement « hétérogènes ».
Cette notion est importante.
Idéalement, il faudrait associer des évènements qui soient de gravité à peu près égale, pour justement que le critère composite soit homogène.
Ainsi, par exemple, si le critère associant « mortalité cardio-vasculaire+arrêt cardiaque récupéré » semble cohérent, celui-là, associant « mortalité cardio-vasculaire+dyspnée » le semble moins.
Dans le choix d’un traitement chez un patient donné, aucun clinicien ne va mettre une amélioration de la dyspnée et une diminution de la mortalité sur le même plan.
On voit donc déjà que l’association « Doublement de la créatininémie+développement d’une insuffisance rénale terminale+décès toutes causes confondues » n’est pas forcément très pertinente sur le plan clinique.
Tercio, les auteurs du BMJ ont remarqué que la probabilité de survenue dans le groupe placebo et l’effet du traitement sur chaque évènement dans le groupe traité sont eux-mêmes très hétérogènes.
Ainsi, les évènements les plus graves sont les moins fréquents (2.5%), alors que si l’on ajoute les évènement mineurs on arrive à près de 21.7%. Autrement dit, en terme de fréquence de survenue, les évènements majeurs sont souvent noyés dans les mineurs au sein d’un critère composite.
Par ailleurs, si l’on s’intéresse à l’efficacité du traitement, on se rend compte que ce sont les évènements mineurs qui en bénéficient le plus par rapport aux évènements majeurs. Presque du simple au double, en fait.
Soyons (très) caricatural.
Imaginons un traitement X qui améliore de 30% le critère composite suivant : « Mortalité toute cause+temps passé à se ronger les ongles sur 24 heures » chez 1000 sujets anxieux (500 traités, contre 500 sous placebo).
Le produit X semble être très prometteur.
Toutefois, le critère est déjà clairement inhomogène.
Mais si en plus, on n’observe que 2 décès dans le groupe placebo mais 330 rongeurs d’ongles, et que X diminue surtout le temps passé à se les ronger, on va trouver X nettement moins intéressant.
Maintenant, reprenons le premier exemple.
Dans le groupe placebo, 23.7% des patients ont doublé leur créatinine, 17.8% ont atteint le stade d’insuffisance rénale terminale et 16.3% sont décédés.
On peut donc considérer que près de 23.7% des sujets ont présenté un évènement « mineur ».
On pourra discuter sans fin du caractère mineur ou non de doubler sa créatinine, mais il me semble surtout mineur par rapport aux deux autres évènements.
Maintenant, quel est l’effet de l’irbésartan par rapport au placebo et à l’amlodipine pour chaque évènement du critère principal composite ?
Et bien, on peut le voir sur le petit graphique suivant, publié dans l’étude du BMJ, et qui n’est évidemment pas présent dans celle du NEJM.
Par rapport à l’amlodipine, l’irbésartan ralentit le doublement de la créatinine plasmatique, mais n’améliore ni la survenue d’une insuffisance rénale terminale, ni la survenue d’un décès. On observe même une tendance non significative à augmenter la mortalité !
Mais lorsque l’on ajoute l’ensemble de ces évènements, le bénéfice de l’irbésartan devient éclatant.
Attention, je ne dis pas que l’irbésartan a un effet délétère sur la mortalité !
L’analyse de sous groupes non spécifiés au départ est en effet formellement déconseillée, car elle ne s’adosse pas à une analyse statistique robuste préalable.
Toutefois dans cette étude, encore une fois, c’est clairement l’efficacité de l’irbésartan sur un critère « mineur » qui rend cette étude positive et suffisamment puissante du point de vue statistique).
Maintenant que vous savez tout cela, avez-vous autant envie de prescrire de l’irbésartan chez vos diabétiques avant d’avoir des analyses complémentaires ?
L’article du BMJ est disponible gratuitement ici.
14:10 Publié dans Prescrire en conscience | Lien permanent | Commentaires (4)