24/08/2008
Let’s talk about stats (2).
Il y a pas mal de temps, j’avais écrit ce billet sur les essais de non infériorité, et les risques de mauvaise interprétation clinique induits par leurs spécificités statistiques.
Depuis, j’ai lu plusieurs articles qui m’ont permis de corriger et d’affiner très partiellement mes idées sur le sujet.
Comme j’ai constaté que le théorème de Bayes vous a intéressé, et que la compréhension d’un minimum sur les statistiques biomédicales me semble fondamental pour optimiser sa pratique médicale, je vais donc essayer de faire une petite note de synthèse sur ce sujet.
Comme d’habitude, n’hésitez pas à commenter pour critiquer et enrichir le sujet.
Un test de « non infériorité » permet, comme le précisent Michel Cucherat et Eric Vicaut « de montrer que l’efficacité d’un nouveau traitement n’est pas trop inférieure à celle du traitement de référence, mais pas de conclure à la stricte équivalence d’efficacité ».
Imaginons une maladie X qui possède un paramètre mesurable pertinent pour l’évaluation de son pronostic.
Imaginons un traitement de référence, R, parfaitement connu (il a donc notamment été testé avec succès contre un placebo), et un traitement nouveau N en cours d’évaluation.
Comment comparer ces deux traitement R et N ?
Il suffit de faire un test d’hypothèses pour tester leur différence D.
C’est le choix de ces hypothèses H0 et H1 (l’hypothèse alternative) qui va déterminer le type de l’essai
Pour les essais de non infériorité, les deux hypothèses sont les suivantes :
H0 : risque absolu de différence ≥marge
H1 : risque absolu de différence <marge
La non infériorité est acceptée si la limite supérieure de l’intervalle de confiance de la différence D est strictement inférieure à la limite supérieure de cette marge, ce qui est le cas dans l’exemple suivant:
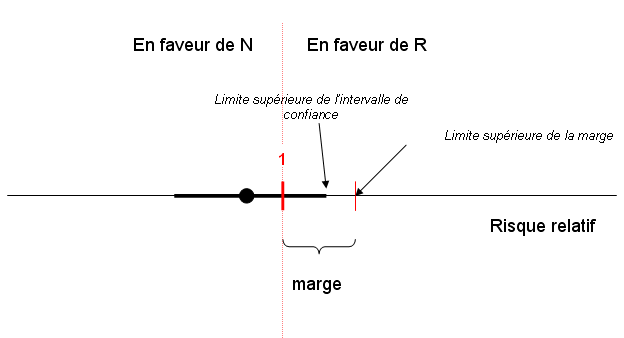
Le choix de cette marge est donc un préalable absolument fondamental. Plus la marge est importante, et plus l’essai a de chances d’être « positif » pour N, mais au prix d’accepter une différence cliniquement inacceptable entre N et R.
Le malheur est qu’il n’existe pas de moyen statistique univoque pour le faire. Ce sont des critères « cliniques », et les résultats des essais préalables qui permettent de l’estimer.
Il existe tout de même un « consensus » qui oriente ce choix : la marge doit être environ égale à 50% d’une valeur égale à 95% du risque absolu de la différence entre R et un placebo.
Par exemple, prenons l’essai ONTARGET qui compare le telmisartan et le ramipril chez des patients à haut risque cardio-vasculaire.
Le risque relatif du ramipril par rapport au placebo dans l’étude HOPE était de 0.775. Les auteurs de ONTARGET ont choisi le 40ème percentile de cette valeur, soit 0.794 « afin de mieux estimer » l’effet du ramipril. Cela donne une valeur du risque relatif de 1.26 (soit 26% d'augmentation du risque relatif). Les auteurs de ONTARGET ont donc choisi comme marge la valeur égale à 50% de ce risque, soit 1.13 (13%).
A posteriori, ONTARGET a permis d’observer le résultat suivant :
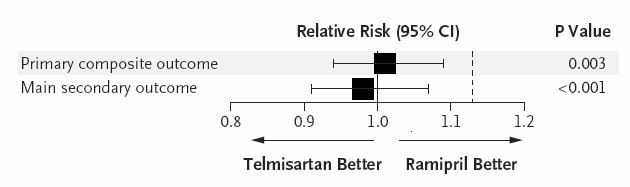
Soit une différence maximale potentielle d’efficacité de 9% (borne supérieure de l’intervalle de confiance à 1.09).
Quoiqu’il en soit, malgré cela, les auteurs et les « leaders d’opinion » ont conclu que les deux traitements étaient identiques :


(numéro d'avril 2008 de "Consensus Cardio News")
Mais vous comprenez maintenant pourquoi on ne peut pas conclure à une stricte équivalence d’un point de vue statistique, car on tolère toujours dans ces essais un certain degré de perte d’efficacité.
Par contre, les cliniciens ont bien voulu sacrifier un peu d’efficacité du ramipril (potentiellement jusqu’à 9%, donc) contre une meilleure tolérance clinique pour le telmisartan et conclure in fine en « l’équivalence » des deux produits
Mais quand on veut promouvoir un article ou un produit, vaut mieux ne pas s’embarrasser de telles subtilités qui pourraient faire réfléchir le lecteur-prescripteur.
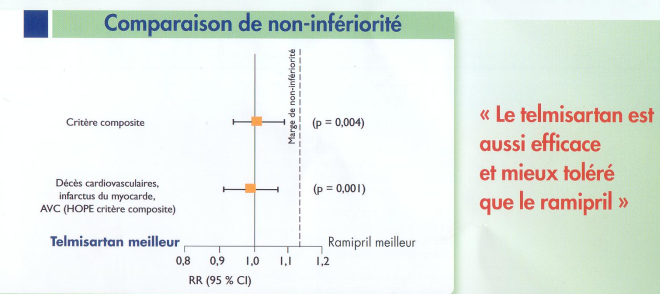
(même numéro d'avril 2008 de "Consensus Cardio News")
"Le telmisartan est aussi efficace (vrai si l'on accepte, justement la possibilité d'une perte partielle d'efficacité...) et mieux toléré que le ramipril (peut-être vrai, mais la tolérance n'était ni un critère primaire, ni un critère secondaire de ONTARGET)". Evidemment, vu comme cela, le slogan devient alors beaucoup moins sexy...
J’ai pris ONTARGET comme premier exemple, car l’ensemble de la communauté scientifique le considère comme un « bon » essai de non-infériorité.
Maintenant, nous allons considérer une série de « mauvais » essais, la série des essais SPORTIF.
Le programme de recherche SPORTIF comparait l’efficacité de la warfarine, un antivitamine K, et le ximelagatran un inhibiteur de la thrombine dans la prévention des accidents thrombo-emboliques chez des patients en fibrillation auriculaire.
La warfarine étant le traitement de référence, le ximelagatran étant le traitement alors en cours d’évaluation. Ne le cherchez pas en pharmacie, ce traitement a été retiré du marché quelques années plus tard pour un problème de toxicité hépatique.
Ce superbe article dissèque en détail ce programme, et notamment critique sévèrement la méthodologie des essais de non-infériorité.
Les auteurs de SPORTIF sont partis d’un taux d’événements thrombo-emboliques annuels de 3.1% pour la warfarine et d’une marge de non infériorité de 2% pour la différence absolue.
Si les auteurs avaient appliqué la règle communément admise des 50% dont j’ai parlé plus haut, ils auraient dû prendre une marge de 1%.
1%, 2%, cela peut sembler peu. Mais nous raisonnons en terme de différence absolue.
Si l’on considère la différence relative tolérée par les auteurs, on obtient une marge qui est au maximum de 1.65, soit près de 65%.
Autrement dit, les concepteurs de ces essais ont estimé que le ximelagatran sera « équivalent » à la warfarine, même si cette dernière est 65% plus efficace.
Pourtant, ces essais ont été publiés dans des journaux prestigieux, le Lancet, le JACC et le JAMA.
La conclusion des auteurs de l’article publié dans le Lancet est d’ailleurs tout à fait claire :

Et la subtilité du choix de la marge, qui n'en est pas une, a été « expédiée » en 2 lignes dans l’analyse statistique :

A l’époque, les réactions ont été dithyrambiques, par exemple de la part d’un très grand nom de la cardiologie française (mondiale) le 02/04/03 :
« Session chair Dr Jean-Pierre L B*** (University Hospital of Besanon [sic], France) called these results a "major breakthrough" for patients with AF. "No titration, fixed dose, no control of blood coagulation is definitely a major success, a major breakthrough, and we are all eagerly awaiting the results of the SPORTIF V trial." » (source : theheart.org, voir dans les références)
Permettez moi cette aparté qui n'a strictement rien à voir avec le sujet, mais il est toujours très très drôle, bien qu’un peu facile et un peu cruel de rechercher sur le net les déclarations péremptoires faites à l’époque par nos grands leaders d’opinion sur telle ou telle molécule qui a fait quelques mois ou années après un flop médical retentissant.
Autre exemple du 19/03/2005, pris au hasard (même source, ici) :
« "Le message de RIO Europe qui recoupe celui de RIO NA est que la perte de poids se maintient, de même que la perte du tour de taille et les effets secondaires après une longue période sont pratiquement inexistants. Ils surviennent dans les premières semaines voire mois puis ils s'abaissent" a indiqué le Pr Jean-Pierre B*** à Heartwire (Centre Hospitalier Jean Minjoz, Besançon). ».
(Pour rappel, la dernière mise en garde du 05/08/08 de l’Afssaps concernant le Rimonabant.)
Mais je m’égare, revenons à nos moutons.
Par ailleurs, les auteurs de l’article du JACC estiment à 1.9% plutôt qu’à 3.1% le nombre d’évènements annuels sous warfarine selon des séries « historiques ». Ils accusent donc aussi les auteurs des essais SPORTIF d’avoir sous-estimé de près de 50% l’efficacité de la warfarine, afin, bien entendu de favoriser le ximelagatran.
Heureusement que la FDA a des experts en statistiques, car l'intervalle de 2% a quand même fait tiquer l'agence. Finalement, l'hépatotoxicité (à cette époque supposée) du ximelagatran et ces fameux 2% font faire retoquer la demande d'extension d'AMM du laboratoire concernant la fibrillation auriculaire. C'est cette même hépatotoxicité qui va finalement conduire au retrait définitif de ce produit le 13/02/2006.
Autrement dit, un médecin qui fait uniquement confiance à l’information parcellaire ne reprenant que la conclusion de l’article, une information généreusement apportée (pas donnée) par l’industrie pharmaceutique ou des leaders d’opinion n’a absolument aucune chance de pouvoir avoir une réflexion critique dessus.
Un médecin « lambda » qui a la volonté de lire l’article n’aura que peu de chance de mettre en cause la conclusion.
Seul un médecin avec une solide culture statistique et beaucoup de temps devant lui pourra critiquer cet article. Dans l’immense majorité des cas, ce médecin n’est pas prescripteur.
Je tire de tout cela deux conclusions et demi.
Primo, je jette à la poubelle de façon systématique tout article qui n’est pas de supériorité, tant leur analyse me semble complexe. Complexité à la hauteur des possibilités de bidouillage de la part des auteurs.
Secundo, il est très difficile d’être à la fois prescripteur et capable d’analyser les données scientifiques sur lesquelles, pourtant, se basent nos prescriptions.
Secundo et demi, je n’écoute jamais les leaders d’opinion.
Ajout du 25/08/08: merci à JPJ d'avoir relu mon texte et de m'avoir envoyé par mail ses corrections éclairées
°0°0°0°0°0°0°0°0°0°
Références:
Vicaut E, Cucherat M. Essais de non-infériorité : quelques principes simples. Presse Med. 2007 Mar;36(3 Pt 2):531-5. Epub 2007
The ONTARGET Investigators. Telmisartan, Ramipril, or Both in Patients at High Risk for Vascular Events. N Engl J Med. 2008 Apr 10;358(15):1547-59
Kaul S, Diamond G, Weintraub W .. Trials and Tribulations of Non-InferiorityThe Ximelagatran Experience. Journal of the American College of Cardiology , Volume 46 , Issue 11 , Pages 1986 - 1995
Executive Steering Committee on behalf of the SPORTIF III Investigators. Stroke prevention with the oral direct thrombin inhibitor ximelagatran compared with warfarin in patients with non-valvular atrial fibrillation (SPORTIF III): randomised controlled trial. The Lancet, Volume 362, Issue 9397, 22 November 2003, Pages 1691-1698
Susan Jeffrey. SPORTIF III: Ximelagatran as effective as warfarin to prevent stroke in AF. theheart.org. [HeartWire > News]; Apr 2, 2003. Accessed at http://www.theheart.org/article/256561.do on Aug 24, 2008
°0°0°0°0°0°0°0°0°0°0°0°
Pour aller plus loin sur les essais de non-infériorité :
Kleist P. Dix exigences aux études d’équivalence thérapeutique ou Pourquoi absence de preuve d’une différence ne signifie pas la même chose qu’équivalence. Forum Med Suisse 2006;6:814–819
Un éditorial trouvé dans la revue Minerva.
Mismetti P, Laporte S, Cucherat M. Les essais de non-infériorité. Médecine thérapeutique. Volume 13, Numéro 4, Juillet-Août 2007 (accès payant)
La lecture critique des essais cliniques par Michel Cucherat, un polycopié disponible ici (son sujet dépasse largement les essais de non-infériorité).
Pour les geeks fanatiques de ce type d’essais, une page permettant d’estimer le nombre de patients à inclure dans un essai de non infériorité en fonction de différents paramètres.
15:38 Publié dans Prescrire en conscience | Lien permanent | Commentaires (3)
10/08/2008
Let’s talk about stats.
Je vais essayer de faire une petite synthèse sur le théorème de Bayes, sans rentrer dans une théorie qui m’est largement imperméable, c'est à dire en restant pratique.
D’abord, les présentations.
Je vais m’intéresser exclusivement à l’étude de la performance d’un test médical de dépistage T d’une maladie M.
T peut être positif (T+), ou négatif (T-)
Un sujet peut être atteint par la maladie (M+) ou sain (M-)
|
| M(+) | M(-) |
| T(+) | VP | FP |
| T(-) | FN | VN |
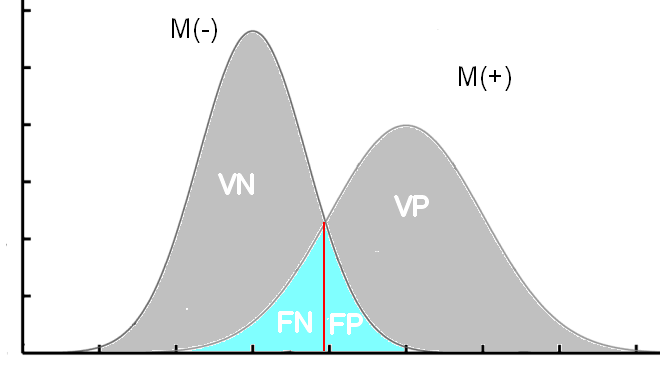
VP= vrai positif, FP= faux positif, VN= vrai négatif, FN= faux négatif
La sensibilité Se est la capacité d’un test à identifier correctement les sujets malades.
Se= VP/ (VP+FN)
La spécificité Sp est la capacité d’un test à identifier correctement les sujets sains.
Sp= VN/ (VN+FP)
Note : pour déterminer qui est malade et qui ne l’est pas, il a fallu utiliser une méthode indiscutable (on verra que c’est justement un point discutable en pratique) et indépendante du test T. On peut alors disposer de deux populations « indiscutables » : les sujets sains et les sujets malades.
Ca va pour l’instant ?
Allez respirez un grand coup, ça se complique un peu.
Malheureusement, du moins pour la simplicité, la vie n’est pas blanche ou noire, il y a beaucoup de gris.
C’est pareil pour les tests médicaux.
L’ensemble des individus d’une population donnée n’aura pas un même résultat du fait de la variabilité biologique.
Ces résultats vont se distribuer selon la loi normale de Laplace-Gauss, et donner une belle courbe de Gauss (qui aurait pu s’appeler courbe de Laplace, sans ce maudit allemand !).
Quand on compare deux populations, les malades M(+) et les sains M(-), il y a de grandes chances que les deux courbes se croisent.
C'est-à-dire qu’il va falloir déterminer un seuil qui permettra de déterminer des sujets T(-) ou T(+).
C’est là que ça se complique, car déterminer ce seuil (en rouge sur les courbes) est une délicate question d’équilibre entre la sensibilité et la spécificité. Il va falloir choisir de privilégier l’une ou l’autre.
Plus le seuil est bas, plus on va diminuer le nombre de FN (on va donc augmenter la sensibilité), mais on va aussi augmenter le nombre de FP, et donc diminuer la spécificité.
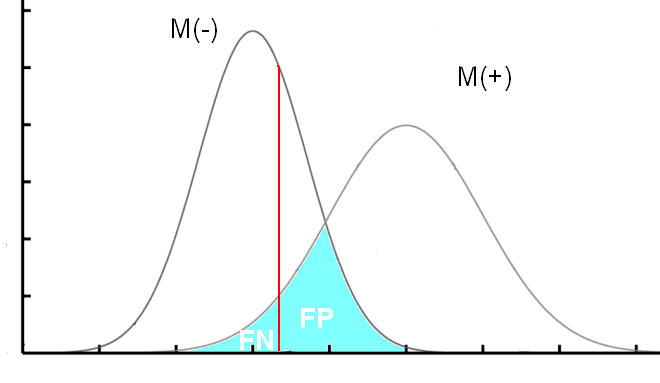
Je ne vais pas rentrer dans les détails, mais ce choix dépend de ce que l’on veut faire du test, c'est-à-dire si on veut le rendre très spécifique ou au contraire très sensible. On peut aussi déterminer ce seuil à l’aide d’une courbe « ROC » (Receiver Operating Charactéristics).
Mais sachez que le choix d’un seuil de positivité d’un test est délicat, complexe et parfois sujet à caution.
Dans la vie réelle, le patient et son médecin se fichent un peu de savoir quelle est la sensibilité, la spécificité d’un test, ou si sa courbe ROC est sexy.
Ce qu’ils veulent savoir c’est
Quelle est la probabilité d’être malade quand le test est positif, c’est à dire la valeur prédictive positive (VPP)?
Quelle est la probabilité d’être sain quand le test est négatif, c’est à dire la valeur prédictive négative (VPN)?
C’est là qu’intervient le théorème de Bayes (qui aurait pu s’appeler théorème de Laplace, sans ce maudit anglais !).
Pr est la prévalence de la maladie dans la population, c'est-à-dire la proportion de la maladie dans une population définie, à un instant t
Pr = nombre de cas observés à un instant t /population à risque au même instant t
VPP = (Se*Pr) / (Se*Pr)+(1-Sp)*(1-Pr)
VPN = (Sp*(1-Pr)) / (Sp*(1-Pr) + (1-Se)*Pr)
Deux « grosses » formules que seuls les étudiants en médecines qui doivent passer des examens/concours déterminants pour leur vie arrivent à retenir plus de quelques heures.
Mais on peut essayer d’analyser ces formules sans faire de méningite ou déclencher une migraine.
On constate que la VPP et la VPN d’un test dépendent de la prévalence de la maladie.
Plus la prévalence est élevée, plus la VPP est élevée, et plus la VPN est faible.
Plus la prévalence est faible, plus la VPP est faible, et plus la VPN est élevée.
Ca, c’est fondamental à comprendre pour notre pratique quotidienne, presque aussi important que le « primum non nocere » (j’exagère un peu).
Autrement dit, si l’on effectue un test dans une population où la prévalence de la maladie est faible (dans une population à faible risque, pour exprimer les choses autrement) la probabilité qu’un patient avec un test positif soit effectivement malade sera faible, voire très faible. Au contraire, la probabilité qu’un patient soit sain en ayant un test négatif sera très élevée.
Un même test aura donc une performance variable en fonction de la population étudiée.
Si je fais une série d’épreuves d’effort à la recherche d’une coronaropathie aux enfants d’une crèche, un test positif sera peu inquiétant, un test négatif très rassurant.
Si je fais les mêmes épreuves d’effort à la recherche de la même chose dans une population d’hommes dépassant la cinquantaine, hypertendus, tabagiques et diabétiques non traités, un test positif sera très probablement révélateur d’une coronaropathie latente, alors qu’un test négatif sera finalement peu rassurant.
Vous comprenez donc que la performance d’un test est très variable selon le patient à qui on le fait passer. Donc, en corollaire, l’interprétation qu’en fait le médecin doit être adaptée à chaque patient.
C’est difficile à imaginer, mais c’est ainsi: la performance d’un test dépend d’un paramètre qui lui est totalement étranger, la prévalence d’une maladie dans une population.
(moi, cette notion m’a toujours fasciné)
En général, c’est à ce point précis que j’entrevois qu’une bonne partie des examens que l’on me demande, bien que rémunérateurs, sont peu informatifs d’un point de vue statistique.
Prenons l’épreuve d’effort.
Selon cette source, sa sensibilité est environ de 68%, sa spécificité environ de 77%.
Selon cette autre source, la prévalence d’une coronaropathie diagnostiquée à l’angiographie coronaire dans une population générale de 40 à 70 ans est de 7.4%.
Il faut se méfier de jouer à l’apprenti sorcier avec les chiffres, mais cela donne une VPN à 96.79% et une VPP à 19.11%. Ce cas illustre bien le manque de pertinence d’une épreuve d’effort positive dans une population à relativement faible risque.
Dans une population d’insuffisants rénaux à très haut risque, ce papier évalue la prévalence d’une coronaropathie à 53.3%
On obtient alors une VPN à 67.83% et une VPP à 77.14%.
On se rend compte ici que l’épreuve d’effort est ici finalement assez peu pertinente (et encore, je ne tiens pas compte des faibles capacités fonctionnelles musculaires des insuffisants rénaux en stade terminal, diminuant d’autant les performances du test d’effort).
Dans un nombre non négligeable de cas, on se trompe par excès ou défaut.
Vous comprenez donc aussi le paradoxe (apparent) de l'anesthésiste et du cardiologue qui demandent en pré-opératoire un test d'effort pour se rassurer chez un patient à très haut risque cardio-vasculaire. Plus le risque du patient est élevé, et plus la probabilité d'être faussement rassuré par un test négatif est forte. Le "Je l'endors (ou "tu peux l'endormir") tranquille car l'épreuve d'effort est rassurante" prend alors toute sa saveur...
Bien évidemment, en pratique il faut faire une épreuve d'effort avant une chirurgie lourde pour un patient à haut risque. Mais contrairement à ce que l'on croit, c'est plutôt pour sa capacité à dépister une coronaropathie qu'à être "rassuré" avant l'intervention.
Deuxième conséquence de la formule, un peu plus intuitive, celle-çi :
La valeur prédictive d’un test dépend de sa spécificité et de sa sensibilité.
Plus la Sp est élevée, plus la VPP est élevée.
Plus la Se est élevée, plus la VPN est élevée.
Ici, pas trop de soucis, la pertinence d’un test est directement dépendante de ses caractéristiques propres.
Tout cela pour ça, me direz vous…
Cette loi a été décrite par le révèrent Bayes à la fin du XVIIIème, mais sa non compréhension induit au quotidien des demandes statistiquement aberrantes d’examens complémentaires et aussi et surtout des interprétations tout aussi aberrantes que dangereuses pour le patient. Ce ne sont pas tellement les tests qui posent problème, mais plutôt la population dans laquelle ils sont effectués et l'interprétation qu'en fait le médecin demandeur.
Quoique…
Cette note de Jean Daniel Flaysakier évoque un commentaire publié dans le prestigieux magazine Nature sur la fiabilité des tests utilisés pour lutter contre le dopage sportif.
Bien que Donald Berry, l’auteur (un statisticien) a été rétribué par la défense d’un athlète suspecté de dopage en 1996 (merci la déclaration de conflits d’intérêts), son texte apporte un point de vue assez différent de « l’idée commune » qui prévaut sur le sujet.
Faites vous votre opinion.
°0°0°0°0°0°0°0°0°0°0°0°0°
Une fois n’est pas coutume, une petite modification de dernière minute.
Stéphane a aussi évoqué le dopage, mais cette fois en terme d’efficacité dans cette note. Je l’avais lue, mais sur le coup je n’y avais pas pensé. Merci de l’avoir rappelé dans ton commentaire !
12:36 Publié dans Prescrire en conscience | Lien permanent | Commentaires (9)
23/07/2008
L'orchestre du Titanic
Stéphane nous raconte aujourd’hui la nouvelle déconvenue de l’ezetimibe dans un essai récent, SEAS. Derek Lowe y fait aussi allusion dans ce billet.
J’ai déjà parlé plusieurs fois de l’étude ENHANCE sur ce blog (le dernier billet est ici), j’en ai fait une synthèse que j’ai envoyé à Prescrire il y a quelques semaines.
Ils m’ont envoyé une réponse plutôt encourageante, et j’espère toujours…
Comme on reparle donc de l’ezetimibe, je me suis dit que ça vous intéresserait peut-être de lire mon petit texte.

°0°0°0°0°0°0°0°0°0°0°0°
L’essai « ENHANCE » dont le but était d’apprécier l’effet de l’ezetimibe, un médicament hypocholestérolémiant, alimente depuis novembre 2007 une histoire à rebondissements, digne d’un scénario des meilleures séries télévisées.
Le Dr. John Kastelein, l’investigateur principal a même parlé « d’essai sorti de l’enfer » (1).
Cette petite étude de moins de 1000 patients a presque poussé dans l’ombre les résultats pourtant très attendus de ONTARGET (25620 patients), fait l’objet de trois publications dans le même numéro du New England Journal of Medicine (NEJM) (2, 3, 4), d’une publication dans le Journal of American Medical Association (JAMA) (5), de plusieurs articles dans les prestigieux Wall Street Journal (6, 7) et New York Times (8, 9), et de débats parfois houleux à la grand-messe de la cardiologie mondiale de l’American College of Cardiology/American Heart Association (ACC/AHA) qui s’est tenue du 29 mars au premier avril 2008 à Chicago (10, 11, 12, 13). Par ailleurs, deux comités parlementaires américains enquêtent actuellement sur la conduite de cette étude par les deux laboratoires pharmaceutiques commercialisant l’ezetimibe, Schering-Plough et Merck. Enfin, à Wall Street, à la suite de la présentation de ENHANCE, et de sa publication dans le NEJM, l’action de Schering-Plough a plongé de 26%, et celle de Merck de 15%.
L’étude ENHANCE, publiée dans le NEJM le 3 avril dernier compare sur une durée de 24 mois, l’efficacité de 80 mg de simvastatine seule ou en association avec 10 mg d’ezetimibe chez 720 patients atteints d’hypercholestérolémie familiale (2).
Le critère principal de l’étude était la variation de l’épaisseur de l’intima media au niveau des artères carotides.
Les résultats montrent qu’il y a aucune différence entre les deux groupes (+0.0058±0.0037 mm pour la simvastatine contre +0.0111±0.0038 mm pour l’association simvastatine et ezetimibe, p=0.29), malgré une différence relative significative de 16.5% entre les taux de LDL-cholestérol, en faveur de l’association simvastatine et ezetimibe (p<0.01).
Pourquoi une étude de petite taille, faite sur une population porteuse d’une forme assez rare de dyslipidémie, dont le critère principal est un critère intermédiaire, et négative de surcroît a déclenché une telle agitation ?
Pour comprendre, il nous faut revenir quelques années en arrière et dérouler un écheveau bien embrouillé.
L’ezetimibe est titulaire d’une AMM (Autorisation de Mise sur le Marché) aux Etats-Unis depuis fin 2002, et en France par procédure de reconnaissance mutuelle depuis le 11 juin 2003 (14).
Le dossier européen d’AMM ne comporte aucune étude de morbi-mortalité, mais des études comparant l’efficacité de l’ezetimibe à celle d’autres statines uniquement sur les paramètres lipidiques.
En 2004, le magazine « Prescrire » résumait alors parfaitement la situation d’un lapidaire « Un hypocholestérolémiant sans intérêt clinique démontré » (15).
Malgré cela, et grâce à un marketing très actif, l’ezetimibe, seul ou associé à une statine s’est octroyé aux Etats-Unis près de 15.2% des ventes d’hypocholestérolémiants en 2006, et un chiffre d’affaire de 5 milliards de dollars en 2007 (16).
Assez rapidement, Schering-Plough et Merck rédigent des protocoles d’essais cliniques afin d’étoffer les mérites de cette molécule, qui il faut bien le dire, étaient particulièrement ténus lors de leur obtention d’AMM (17).
Ainsi, l’étude ENHANCE débuta en juin 2002, pour se terminer en avril 2006.
Mais la « vraie » grande étude, dont le protocole a été déposé auprès du registre américain des études cliniques le 13 septembre 2005 est « IMPROVE-IT », avec des objectifs primaires cliniques (18).
Cette essai, débuté en octobre 2005, porte sur près de 18000 patients. Il a pour objectif primaire la mesure de l’effet d’une association ezetimibe et simvastatine sur la mortalité cardio-vasculaire, les syndromes coronariens non mortels et les accidents vasculaires cérébraux en comparaison avec la simvastatine seule.
Les résultats étaient initialement attendus pour 2011.
L’étude ENHANCE a probablement été lancée afin de donner un peu de grain à moudre aux services marketing en attendant l’année 2011.
Malheureusement, ce qui devait être une promenade de santé scientifique et commerciale s’est transformé en chemin de croix pour Schering-Plough, Merck, et les investigateurs.
Terminée en avril 2006, ENHANCE n’a toujours pas été publiée le 21 novembre 2007 lorsque paraît dans le New-York Times un article s’interrogeant sur les raisons de cette non publication (9). L’article fait notamment part de la volonté des promoteurs de changer le critère principal de l’étude, après la fin de celle-ci, ce qui revient à modifier la position de la ligne d’arrivée après la fin d’une course, et de « frictions et de tensions » entre les firmes pharmaceutiques et l’investigateur principal, le Dr John Kastelein.
Rapidement, la polémique enfle (19) et déclenche l’envoi le 11 décembre d’une demande d’éclaircissement de la part du Comité sur l’énergie et le commerce de la Chambre des Représentants (20).
Dans ce courrier, les responsables du comité, les sénateurs John D. Dingell et Bart Stupak demandent des éclaircissements sur le délai de publication de cet essai, l’enregistrement très tardif sur le registre des essais cliniques (précisément le 31 octobre 2007) et aussi la raison du changement du critère principal.
Le courrier précise par ailleurs que le comité « s’intéresse au délai de publication des résultats, la chronologie d’enregistrement sur le registre des essais, et à l’apparente manipulation des données de l’étude ».
Les promoteurs font marche arrière, décidant de ne plus changer le critère principal. Ils expliquent l’inscription tardive car cette dernière n’était pas obligatoire en 2002 (au début de l’étude), que le délai de publication est expliqué par la difficulté d’interprétations de données très nombreuses et dont certaines semblent être « invraisemblables ». Enfin, ils réfutent l’accusation de manipulation en arguant que les données sont toujours sous embargo.
Les rumeurs enflent de plus belle, notamment que l’étude est « négative » et que les promoteurs cherchent à l’enterrer (21).
Le Dr. John Kastelein se porte sur tous les fronts, et répète l’argumentation des promoteurs : personne ne connaît les résultats de l’étude, et le délai vise à rendre optimal l’analyse des données.
Toutefois il concède que les représentants des laboratoires pharmaceutiques sont rendus particulièrement nerveux par les enjeux financiers considérables de cette étude poussée bien malgré eux sous les feux des projecteurs.
Le 14 janvier 2008, de façon tout à fait inhabituelle, Schering-Plough et Merck publient les résultats partiels de ENHANCE dans un communiqué de presse plusieurs semaines avant leur présentation officielle qui aurait dû avoir lieu au congrès de l’ACC/AHA de mars (22).
Les résultats sont donc négatifs, l’association ezetimibe et simvastatine ne fait pas mieux que la simvastatine seule sur l’épaisseur intima media.
Ce communiqué, loin de calmer les spéculations, va jeter de l’huile sur le feu.
Les experts vont se jeter de plus belle leurs arguments à la face dans les medias et au cours de tables rondes particulièrement tumultueuses. Certains vont même jusqu’à remettre en cause le dogme du « lower is better » des statines, c’est à dire que plus le LDL est bas, mieux c’est. De façon un peu plus générale, des voix s’élèvent afin de critiquer l’utilisation de plus en plus fréquente de critères intermédiaires afin de juger de l’efficacité d’une molécule (13).
Certains patients arrêtent leur traitement à base d’ezetimibe, d’autres envisagent une action juridique de groupe contre les deux firmes pharmaceutiques afin que ces dernières remboursent la différence de coût entre l’association simvastatine et ezetimibe (environ US$97 pour 30 jours pour le dosage 20/10) et le générique de la simvastatine (environ US$6 pour 30 jours), soit 16 fois moins).
L’American College of Cardiology va publier le 15 janvier un communiqué qui tente de calmer le jeu (23). Ce communiqué précise que l’ezetimibe demeure une option de traitement raisonnable chez les patients intolérants aux statines, ou pour qui les objectifs thérapeutiques en termes de taux plasmatiques de LDL et de HDL n’ont pu être atteints malgré un traitement hypocholestérolémiant bien conduit. Par ailleurs l’ACC précise que cette étude ne porte que sur un critère intermédiaire, et qu’il faut donc attendre les résultats d’études cliniques afin de pouvoir porter un jugement définitif.
Neuf jours plus tard, le comité dirigé par le sénateur John D. Dingell envoie un courrier à l’ACC (24) et à l’AHA (25) leur demandant de rendre public l’ensemble des relations financières qui lient ces associations aux laboratoires Merck et Schering-Plough afin de mettre en évidence d’éventuels conflits d’intérêts.
Le 13 mars, un autre comité sénatorial demande à Schering-Plough des éclaircissements sur le « plan 49 », plan marketing qui viserait à « persuader » à coup de repas gratuits les médecins de poursuivre leurs prescriptions d’ezetimibe, malgré ENHANCE (26).
Au cours du congrès de l’ACC/AHA les laboratoires Schering-Plough et Merck indiquent que l’étude IMPROVE-IT est prolongée de 1 an et inclura plus de patients, retardant d’autant sa sortie initialement prévue en 2011.
Enfin, le 11 avril, le Comité du Sénateur Dingell, décidemment très actif dans cette histoire repart à l’assaut des deux laboratoires en posant des questions de plus en plus pointues sur la conduite de l’étude et la publication chaotique des résultats (27). Notamment, les membres du comité s’interrogent sur l’apparente faible implication de l’investigateur principal dans la prise de décisions pourtant cruciales pour cette étude. Enfin, ils demandent des précisions sur une réunion d’experts dont le compte rendu a été réalisé après coup, et dont le contenu n’est même pas endossé par un des participants (28).
Que faut-il tirer de tout cela ?
De l’étude en elle-même, pas grand-chose à notre avis. Cette étude regroupe une poignée de patients porteurs d’une dyslipidémie familiale peu fréquente, et surtout, son objectif primaire est un critère intermédiaire, la variation de l’épaisseur intima-media.
Nous prescrivons un médicament à un patient, non pas pour diminuer l’épaisseur de son intima-media, mais pour diminuer sa morbi-mortalité.
Cependant, certaines personnes vont arguer que faire régresser ce paramètre, c’est diminuer le risque d’évènements cardio-vasculaires. Une méta-analyse parue en 2007 dans The European Heart Journal fait la revue de la littérature sur ce sujet et pondère un peu cette assertion (29). Sur les 34 études comparant la variation de l’épaisseur intima-media avec la survenue d’évènements cardio-vasculaires, 30 montrent bien un lien, mais qualifié de « modeste » par les auteurs de la méta-analyse. Une seule étude faite sur 147 patients, sur une durée de 8.8 ans montre un triplement du risque d’évènements coronariens pour une augmentation de 0.03 mm de l’épaisseur intima-media (30). Pour donner un ordre d’idée, cette variation est 5.2 et 2.7 fois plus importante que celle observée respectivement dans les bras simvastatine seule et ezetimibe+simvastatine de l’étude « ENHANCE ».
Dans le cas de l’étude ENHANCE, nous ne pouvons même pas tirer comme conclusion que l’ezetimibe est inefficace. D’un point de vue scientifique, cette étude est donc non contributive, que ce soit en faveur ou contre l’utilisation de l’ezetimibe.
L’intérêt de ENHANCE est ailleurs. Les débats, les documents rendus publics, les rebondissements de cette histoire nous ont permis de tirer quelques conclusions et de nous poser quelques questions :
- Les différentes manœuvres des promoteurs afin de cacher les résultats décevants de ENHANCE, ou d’en amoindrir l’impact montrent encore une fois leur volonté de ne publier que des études positives, sans tenir compte de l’intérêt scientifique, ou plus prosaïquement de l’intérêt des patients.
- Cette volonté est probablement liée à la financiarisation effrénée de l’industrie pharmaceutique. Les marchés financiers exigent des performances toujours plus hautes, de plus en plus décalées avec la réalité industrielle et le moindre faux pas se solde par une correction tout à fait disproportionnée. Comment expliquer rationnellement qu’une médiocre petite étude de 720 patients puisse faire dévisser la valeur de l’action d’un géant comme Schering-Plough de 26% en quelques heures?
- L’ezetimibe, dont l’AMM date de 2002 aux Etats-Unis et 2003 en France n’a toujours pas démontré le moindre effet clinique. Pourquoi est-il toujours autant prescrit ?
- Que penser de la valeur des critères intermédiaires pour juger de l’efficacité d’un médicament, notamment lorsque celui-ci ne nécessite pas une commercialisation accélérée pour un problème de santé publique grave et urgent, et qu’il n’est pas le premier à être efficace dans une indication ? Ne vaudrait-il pas mieux attendre dans l’intérêt du patient les résultats d’études de morbi-mortalité avant de délivrer une AMM ? Le nombre élevé de sujets à inclure dans ce type d’étude en augmente le coût et le temps de réalisation, mais il permet de déceler aisément des effets secondaires parfois fréquents et graves. Ainsi Bruce Psaty et Thomas Lumley opposent dans un article du JAMA les destins de l’ezetimibe et du torcetrapib (5). Ces deux hypocholestérolémiants font effectivement « efficaces » si l’on considère leur action biologique, sur le LDL pour l’ezetimibe, sur le HDL pour le torcetrapib. Toutefois le développement de ce dernier a été arrêté avant sa commercialisation à la suite des résultats intermédiaires de l’essai ILLUMINATE (32) qui a inclus 15057 patients. En effet, après un suivi médian de 550 jours, l’essai a été arrêté à cause d’une majoration du risque d’évènements cardiovasculaires majeurs (RR 1.25), et de la mortalité totale dans le groupe torcetrapib (RR 1.58). Sans cet essai de morbi-mortalité, combien de temps le torcetrapib aurait été librement commercialisé avant de se rendre compte de ses effets délétères ?
En ce qui concerne les hypocholestérolémiants, la FDA a pourtant adopté une position claire en 1990, et à notre connaissance à l’heure actuelle toujours valable : « The objective of lipid-altering therapy is not merely to alter serum lipids but to diminish the morbidity and mortality from cardiovascular disease and/or pancreatitis that is associated with abnormal serum lipid levels ».
Espérons que « ENHANCE » devienne un cas d’école obligeant les laboratoires pharmaceutiques à plus de rigueur scientifique si ils désirent garder un minimum de crédibilité, et les prescripteurs à plus de vigilance afin d’apporter à leurs patients le meilleur traitement possible.
Comme le dit si bien le serment d’Hippocrate : « Dans toute la mesure de mes forces et de mes connaissances, je conseillerai aux malades le régime de vie capable de les soulager et j'écarterai d'eux tout ce qui peut leur être contraire ou nuisible.».
Références :
(1) Scott Hensley. Hell Hath No Fury Like a Vytorin Investigator Scorned. Health Blog (Wall Street Journal’s blog on health and the business of health). http://blogs.wsj.com/health/2008/03/31/hell-hath-no-fury-...
(2) Kastelein JJ, Akdim F, Stroes ES, et al. Simvastatin with or without ezetimibe in familial hypercholesterolemia. N Engl J Med 2008; 358:1431-1443.
(3) Brown BG, Taylor AJ. Does ENHANCE Diminish Confidence in Lowering LDL or in Ezetimibe ? N Engl J Med. 2008 Apr 3;358(14):1504-7
(4) Drazen JM, Jarcho JA, Morrissey S, Curfman GD. Cholesterol Lowering and Ezetimibe. N Engl J Med. 2008 Apr 3;358(14):1507-8
(5) Psaty BM, Lumley T. Surrogate end points and FDA approval: a tale of 2 lipid-altering drugs. JAMA. 2008 Mar 26;299(12):1474-6.
(6) Winslow R, Rubenstein S. Trial and error: delays in drug's test fuel wider data debate. Wall Street Journal, March 24, 2008.
(7) Winslow R, Rubenstein S. Schering, Merck Defend Their Drugs As Stocks Suffer
Wall Street Journal, April 1, 2008.
(8) Berenson A. Data about Zetia risks was not fully revealed. New York Times, December 21, 2007.
(9) Berenson A. After a Trial, Silence. New York Times, November 21, 2007.
(10) Jacob Goldstein. Health Blog (Wall Street Journal’s blog on health and the business of health). Vytorin Postgame: Worse Than Expected. http://blogs.wsj.com/health/2008/03/31/vytorin-postgame-w...
(11) Michael O'Riordan. ENHANCE published, presented, discussed, and debated: Experts mull over what the findings mean. theheart.org. [HeartWire > Dyslipidemia]; March 30, 2008. Accessed at http://www.theheart.org/article/851409.doon Apr 16, 2008.
(12) Michael O'Riordan. Ezetimibe controversy continues: IMPROVE-IT enlarged and delayed, the inside struggle over ENHANCE. theheart.org. [HeartWire > News]; March 31, 2008. Accessed at http://www.theheart.org/article/852455.doon Apr 16, 2008.
(13) Surrogate end points on trial: ENHANCE and other controversies. theheart.org. [Editorial series > The Cardiology Show]; April 04, 2008. Accessed at http://www.theheart.org/article/855277.doon Apr 16, 2008.
(14) AFFSAPS. Rapport public d’évaluation de l’ezetimibe (septembre 2004). http://agmed.sante.gouv.fr/htm/5/rappe/data/ezetrol.pdf
(15) Rayon des nouveautés en soins ambulatoires : Ezétimibe. Rev Prescrire 2004 ; 24 (251) : 405-409.
(16) Jackevicius CA, Tu JV, Ross JS, Ko DT, Krumholz HM. Use of Ezetimibe in the United States and Canada. N Engl J Med. 2008 Mar 30.
(17) CLinical Trial : ENHANCE (http://clinicaltrials.gov/ct2/show/NCT00552097)
(18) Clinical Trial : IMPROVE-IT (http://clinicaltrials.gov/ct/show/NCT00202878).
(19) Sue Hughes. Concerns raised on delay of ezetimibe data. theheart.org. November 22, 2007. Accessed at http://www.theheart.org/article/829507.do on Apr 10, 2008.
(20) US House of Representatives, Committee on Energy and Commerce. Letter to Schering-Plough Corporation and Merck & Co., Inc. in regard to withholding of clinical trial data relating to the medical management of hypercholesterolemia. http://energycommerce.house.gov/Investigations/DrugSafety...
(21). Michael O'Riordan. Questions arise about the chronology of events in the ENHANCE trial. theheart.org. [HeartWire > Cardiometabolic risk]; January 31, 2008. Accessed at http://www.theheart.org/article/840879.doon Apr 16, 2008.
(22). Merck/Schering-Plough Pharmaceuticals Provides Results of the ENHANCE Trial. http://www.schering-plough.com/schering_plough/news/relea...
(23). ACC Statement on ENHANCE Trial: http://www.acc.org/enhance.htm
(24). US House of Representatives, Committee on Energy and Commerce. Letter to American College of Cardiology CEO Lewin in regard to the withholding of clinical data during the ENHANCE trial. http://energycommerce.house.gov/Press_110/110-ltr.012408....
(25). US House of Representatives, Committee on Energy and Commerce. Letter to American Heart Association CEO Wheeler in regard to the withholding of clinical data during the ENHANCE trial. http://energycommerce.house.gov/Press_110/110-ltr.012408....
(26). US Senate, Special Committee on Aging. Kohl requests documents from Schering-plough regarding 49 plan sales push. March 13, 2008. http://www.aging.senate.gov/hearing_detail.cfm?id=294743
(27). US House of Representatives, Committee on Energy and Commerce.
After Review of ENHANCE Trial Documents, Dingell, Stupak Express “Serious Concerns”. Merck, Schering-Plough Documents Raise New Questions. http://energycommerce.house.gov/Press_110/110nr248.shtml
(28). Matthew Herper. Vytorin's Man In The Middle. Forbes Magazine. April, 15 2008. http://www.forbes.com/business/2008/04/14/cholesterol-vyt...
(29). Bots ML, Baldassarre D, Simon A, de Groot E, O'Leary DH, Riley W, Kastelein JJ, Grobbee DE. Carotid intima-media thickness and coronary atherosclerosis: weak or strong relations? Eur Heart J. 2007 Feb;28(4):398-406.
(30). Howard N. Hodis, Wendy J. Mack, Laurie LaBree, Robert H. Selzer, Chao-ran Liu, Ci-hua Liu, and Stanley P. Azen. The Role of Carotid Arterial Intima-Media Thickness in Predicting Clinical Coronary Events. Ann Intern Med, Feb 1998; 128: 262 - 269.
(31). Food and Drug Administration. Guidelines for the clinical evaluation of lipid-altering agents in Adults and Children. September, 1990. http://www.fda.gov/cder/guidance/lipid.pdf
(32). Barter PJ, Caulfield M, Eriksson M, et al. Effects of torcetrapib in patients at high risk for coronary events. N Engl J Med. 2007;357(21):2109-2122.
17:45 Publié dans Prescrire en conscience | Lien permanent | Commentaires (5)