25/04/2008
Ad augusta per angusta.
La FDA a proposé à la réflexion de tous, une proposition de texte qui permettrait à l’industrie pharmaceutique de diffuser aux médecins, sous certaines conditions, des informations médicales sur des indications thérapeutiques hors AMM.
Un paragraphe (le FDAMA sec. 401) permettait déjà de le faire dans des conditions bien moins définies jusqu’au 30 septembre 2006. Le texte proposé par la FDA est plus restrictif. Il exige notamment que les revues d’ou sont issus les tirés-à-part comportent un comité de relecture, que les conflits d’intérêts entre auteurs, journaux et firmes pharmaceutiques soient scrupuleusement notés, et enfin que la publication des articles suive une procédure spécifique.
Quels sont les arguments en faveur de ce texte ?
D’abord, l’accès plus rapide des médecins à certaines informations scientifiques, qui pourraient être bloquées par l’embargo de la FDA sur les informations concernant les indications thérapeutiques hors AMM. Ensuite, certaines firmes avaient déjà largement écorné le fameux paragraphe 401, sans pour autant en subir la moindre conséquence judiciaire. Un nouveau texte, un peu moins flou et directif permettrait ainsi de recadrer un peu ces pratiques.
Quels sont les arguments contre ce texte ?L’argument principal est que les deux conditions principales exigées par le projet de texte de la FDA, c’est à dire le comité de lecture et la déclaration des conflits d’intérêts sont parées de « pouvoirs spéciaux » qu’elles n’ont pas. Autrement dit, que ces deux conditions sont dérisoires contre la tentation que pourraient avoir les firmes de désinformer les médecins.
Je vous laisse lire les deux textes (un pour et un contre) ainsi que la proposition de la FDA, afin de vous faire votre opinion.
La question centrale que pose ce débat est finalement l’inféodation de notre droit de prescription à la tutelle. Faut-il accepter de prescrire systématiquement « dans les clous », et suivre à la lettre les recommandations de l’HAS dont nous sommes inondés ?D’un point de vue médico-légal, certainement, mais d’un point de vue purement médical ? Vous savez tout aussi bien que moi qu’un patient ne se laisse pas facilement classer, ordonner.
Le débat est vaste et ouvert, mais il me semble que ce serait aller de Charybde en Scylla que de passer de la tutelle étatique, au tutorat « bienveillant et convivial » des firmes pharmaceutiques.
Par ailleurs, derrière cette histoire de tirés-à-part, se profile une bien triste réalité : très peu de médecins lisent des articles scientifiques. Je ne parle pas bien sûr des articles de Cardiologie Pratique supplément TV, mais d’articles publiés dans des revues ayant une indépendance minimum, et un comité de lecture digne de ce nom.Tout est bon pour justifier cet analphabétisme médical : manque de temps, articles le plus souvent en anglais, le coût de l'abonnement, le ras le bol d’apprendre encore après 10-15 ans d’études…
Mais malheureusement, s’abreuver à la source me semble encore le meilleur moyen d’éliminer tout dévoiement, et de pondérer la tutelle par définition aveugle, afin de prescrire le meilleur traitement pour le patient assis en face de soi, à un instant t.
20:13 Publié dans Prescrire en conscience | Lien permanent | Commentaires (3)
19/04/2008
C’est byzantin ou Byzance ?
Source: Wikipedia
En fait, ça dépend de quel côté on se trouve.
Comme souvent, l’histoire racontée par AS Kesselheim et J Avorn dans un article très récent du NEJM, se déroule aux Etats-Unis.
Vous savez que la régulation fédérale américaine s’appliquant sur les publicités des médicaments est moins restrictive qu’en Europe. Ainsi, la publicité directe aux consommateurs est autorisée (comme en Nouvelle-Zélande, d’ailleurs).
Parmi les conséquences, des prescriptions proportionnelles à l’agressivité commerciale des laboratoires, et non à l’efficacité de la molécule concernée.
Ainsi, l’ézétimibe, qui n’a toujours pas démontré d’efficacité clinique 6 ans après son autorisation par la FDA, et qui n’est pas recommandée en première ligne ni par cette dernière, ni par l’autorité canadienne de régulation atteint en 2006 15.2% des ventes d’hypocholestérolémiants aux EU, contre 3.4% au Canada.
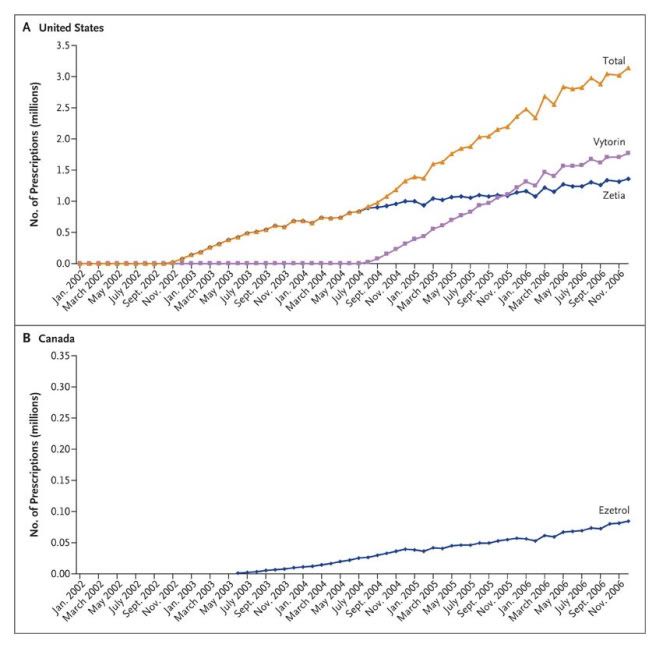
Source: NEJM (2)
Les auteurs de l’article « Use of Ezetimibe in the United States and Canada » citent comme cause probable de cette différence les campagnes publicitaires DTC (« Direct To Consumer ») dont le coût s'est monté à près de 200 millions de dollars US en 2007 pour la seule spécialité Vytorin (son « co-marketing » étant le Zetia). Les autres causes citées sont un délai d’acceptation du dossier d’AMM plus important au Canada, et une pression plus importante des autorités sanitaires sur les praticiens.
Autre étude, autre coïncidence troublante.
Un article de Archives of Internal Medicine s’est intéressée aux prescriptions « hors AMM » aux Etats-Unis.
Il ressort que 21% des prescriptions se font hors AMM à partir des données de 2001, tirées du « National Disease and Therapeutic Index ».
Sur ces 21% de prescriptions hors AMM, 73% ont peu ou pas de justification scientifique.
La palme de la prescription hors AMM en 2001 revient à la gabapentine (83% des prescriptions), alors que justement, le laboratoire qui commercialise cette molécule sera condamné quelques années plus tard, en mai 2004, à payer 430 millions de dollars d’amende au gouvernement fédéral pour « promotion hors AMM ».
Comme quoi, quand on fait de la publicité, les médecins, comme leurs patients, se font influencer. Et cela, bien souvent, indépendamment de toute justification scientifique.
Mais cette régulation est encore trop sévère pour certains qui y voient une restriction au premier amendement de la constitution américaine: « Congress shall make no law . . . abridging the freedom of speech ».
Donc, contrôler la publicité sur les produits pharmaceutiques s’apparenterait à brider la liberté d’expression…
Cela peut paraître totalement fou, mais dans certains cas, cette restriction de la régulation pourrait bien s’appliquer. Ce serait Byzance pour l’industrie pharmaceutique !
Je ne suis pas juriste, et l’article du NEJM (1) est un poil trop technique pour mon anglais, mais pour vous donner une idée des débats juridiques byzantins que cela peut donner, voici un petit schéma qui peut permettre de savoir si une publicité viole ou non le premier amendement :
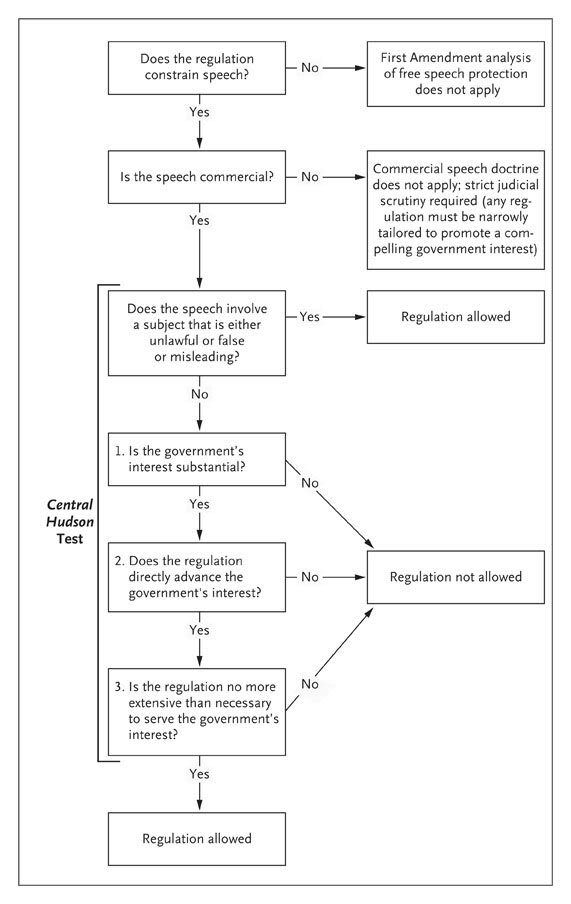
Le "Central Hudson test" est en fait tiré d'une jurisprudence (Central Hudson Gas & Electric Corp. v. Public Service Commission of New York).
On se croirait en plein dans une série judiciaire américaine...
J’espère bien que la publicité « DTC » ne sera jamais autorisée en Europe.
°0°0°0°0°0°0°0°0°0°0°0°
(1) Kesselheim AS, Avorn J. Pharmaceutical promotion to physicians and first amendment rights. N Engl J Med. 2008 Apr 17;358(16):1727-32.
(2). Jackevicius CA, Tu JV, Ross JS, Ko DT, Krumholz HM. Use of Ezetimibe in the United States and Canada. N Engl J Med. 2008 Mar 30 (DOI: 10.1056/NEJMsa0801461), in Print April 24, 2008
(3). Radley DC, Finkelstein SN, Stafford RS. Off-label prescribing among office-based physicians. Arch Intern Med. 2006 May 8;166(9):1021-6.
23:27 Publié dans Prescrire en conscience | Lien permanent | Commentaires (2)
Prescrire en conscience.
Depuis quelques semaines, j’approfondis un peu une volonté que j’ai depuis longtemps, celle de prescrire dans le seul intérêt du patient.
C’est à dire en fonction du patient lui même, de données fiables de la littérature, et de façon indépendante.
En fait, respecter ces trois conditions tient du travail de bénédictin, car comprendre un patient tient du miracle quotidien, échapper aux influences extérieures nécessite une attention de tous les instants, et trouver des données scientifiques non biaisées demande quasiment de devenir statisticien et méthodologiste en plus de médecin.
Alors que je bricolais un peu tout seul de mon côté, j’ai décidé de m’ouvrir assez récemment pour savoir comment font les autres.
J’ai donc adhéré à l’association Formindep, et je viens d’envoyer une demande d’adhésion à l’ « Association Mieux Prescrire », dont la charte "Non merci...", me semble être tout à fait intéressante et salutaire (comme celle du Formindep). L’AMP est responsable de la publication du magazine « Prescrire » dont j’ai très souvent parlé dans ce blog.
J’ai leur ai aussi demandé de juger mon travail en leur envoyant un article qui reprend, en les complétant les différentes notes que j’ai écrites sur l’étude ENHANCE.
Enfin, pour regrouper et retrouver plus facilement toutes les notes ayant un rapport avec l’indépendance de prescription, je les ai regroupées dans une nouvelle catégorie « Prescrire en conscience ». Le titre est franchement pompeux, mais je n’ai pas trouvé mieux ce samedi matin…11:12 Publié dans Prescrire en conscience | Lien permanent | Commentaires (3)





